
С. Л. Булат, П. Л. Васильева, В. Я. Липенков, И. А. Алехина. Молекулярно-биологические исследования ледяного керна со станции Восток
УДК 576.8(99)
Атмосферный и озерный лед со станции Восток - общие проблемы исследования
Ледяной керн из 3623-метровой скважины на станции Восток представлен двумя типами льда - атмосферным и озерным, образованным в результате намерзания воды озера Восток на подошву ледника [Jouzel et al., 1999; Petit et al., 1999]. Граница между ними проходит на глубине 3538-3539 м. Кроме того, озерный лед делится на два типа: тип I, содержащий минеральные включения и образующийся на мелководье в районе небольшого залива; и тип II - без включений, образующийся, по-видимому, в открытой глубокой части озера [Jouzel et al., 1999; Bell et al., 2002].
Изучая микробное содержание атмосферного льда, можно выявить картину микробного разнообразия на протяжении по крайней мере последних 420 000 лет истории климата Земли (4 больших климатических цикла) [Petit et al., 1999]. При этом полагают, что микробы, попавшие в ледниковый покров Антарктиды путем воздушного переноса как единичных клеток, так и их агрегатов с пылью, достаточно многочисленны. Их возможно обнаружить методами оптической микроскопии, эти организмы могут пребывать в состоянии длительного анабиоза, т.е. быть оживлены на питательных средах [Abyzov et al., 1993]. С точки зрения молекулярно-биологического анализа это предполагает присутствие достаточного количества микробной ДНК, пригодной для полимеразной цепной реакции (ПЦР).
Изучая микробное содержание озерного льда, можно выявить обитателей уникального по экологическим условиям озера Восток, которое рассматривается в качестве аналога подледных морей, существующих на покрытых льдом планетах Солнечной системы (например, на Европе - спутнике Юпитера [Carr et al., 1998; Pappalardo et al., 1999]). По предварительным данным озерный лед типа I (с минеральными включениями) также может содержать достаточно микробных клеток для ПЦР, но при условии сохранности ДНК (попытки оживления бактерий из этого льда пока дали противоречивые результаты) [Karl et al., 1999; Priscu et al., 1999; Abyzov et al., 2001].
Цель нашего исследования - проанализировать атмосферный и озерный лед керна со станции Восток путем применения современных методов молекулярной биологии (ПЦР и секвенирования генов рибРНК) на присутствие в нем бактерий, архебактерий и грибов. Однако уже первые результаты показали, что как озерный, так и атмосферный лед весьма бедны ДНК, пригодной для ПЦР, и поэтому проблема контаминации льда и воды чужеродной микрофлорой оказалась особо острой [Булат и др., 2002].
В связи с этим нами были разработаны методы деконтаминации льда и контроля загрязнения образцов льда/воды и окончательно определены условия, необходимые для чистой обработки образцов льда. Для предбио-логической обработки льда была выбрана Лаборатория гляциологии и геофизики окружающей среды (ЛГГОС) в г. Гренобле (Франция), где помимо специальных помещений (ультрачистая комната класса 10 000 с позитивным давлением воздуха и ламинаром класса 100) (рис. 1) и ультрачистой воды (ELGA maxima, UK, производящая воду с содержанием растворенного органического углерода (DOC) не более 3-7 ppb) имеется возможность одновременно проводить анализ воды на содержание растворенного органического углерода (DOC) и некоторых ионов, служащих индикаторами загрязнения.
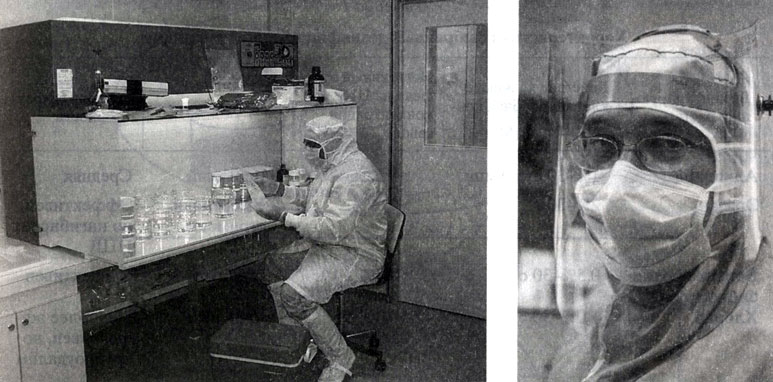
Рис. 1. Обработка образцов льда в ультрачистой комнате класса 10 000 с позитивным давлением воздуха и ламинаром класса 100, ЛГГОС, г. Гренобль, Франция
Разработка методов биодеконтаминации льда и приемов контролирования загрязнения
Методы деконтаминации льда. Нами был опробирован спектр дезинфицирующих растворов (включая растворы нового поколения, не содержащие хлор), пригодных для работы со льдом. Было также изучено их действие на ПЦР, точнее, их следовых количеств, остающихся после обмывки льда водой. Показано, что активно используемый нами деконтаминирующий раствор нового поколения Biohit Proline Biocontrol (Biohit, Финляндия) даже в рабочей концентрации (0,5%) при выдержке 30 с не влияет на эффективность ПЦР (не разрушает ДНК - не ингибирует ДНК полимеразу), в то время как 0,0001% раствор активного хлора (Clorox, США, рабочая концентрация 1,0%) при такой же экспозиции снижает эффективность ПЦР в 10 раз. Таким образом, при равной деконтаминирующей эффективности дезинфицирующие растворы различаются по их влиянию на ПЦР (табл. 1).
| Дезинфицирующий раствор | Действие на живые клетки (рабочая концентрация) | Негативный эффект на ПЦР при концентрации свыше | Стоимость | Общая эффективность |
|---|---|---|---|---|
| Алкидиол | 1%-30 с-5,0 мин | >0,25% | Дешевый | Средняя |
| Эризан | 2%-30 с | >0,02% | Умеренная | Эффективен |
| Биохит пролин-биоконтрол | 0,5%-30 с | >0,5% | Дорогой | Эффективен |
| Хлорин | 1,0%-30 с | >0,0001-0,0005% | Дешевый | Наиболее эффективен, но трудноудалим |
В результате проведенной работы для стандартной процедуры деконтаминации льда (обмывка льда растворами и суперчистой водой, рис. 2) рекомендовано одновременно использовать алкидиол (1%) и частично биохит биоконтрол (0,5%), тогда как для обработки рабочих поверхностей и оборудования - алкидиол (1%) и эризан (2%), а для молекулярной биологии (обработка рук в перчатках и инструментов) - биохит биоконтрол (0,5%).

Рис. 2. Основные этапы стандартной процедуры обработки образцов льда и получения проб талой воды
Однако для обработки особо ценных образцов льда малого размера (например, образцов с размерами 4Х4 см, содержащих минеральные включения или границы кристаллов) нами разработана новая процедура деконта-минации, позволяющая сберечь как можно больший объем льда до его окончательного плавления и в то же время гарантированно деконтаминиро-вать его. Основной дополнительной компонентой этой методики является озон, обработка которым способна эффективно уничтожить как клетки, так и их ДНК на поверхности льда (рис. 3). Данная методика после соответствующей проверки может стать основной при работе с любым типом льда.
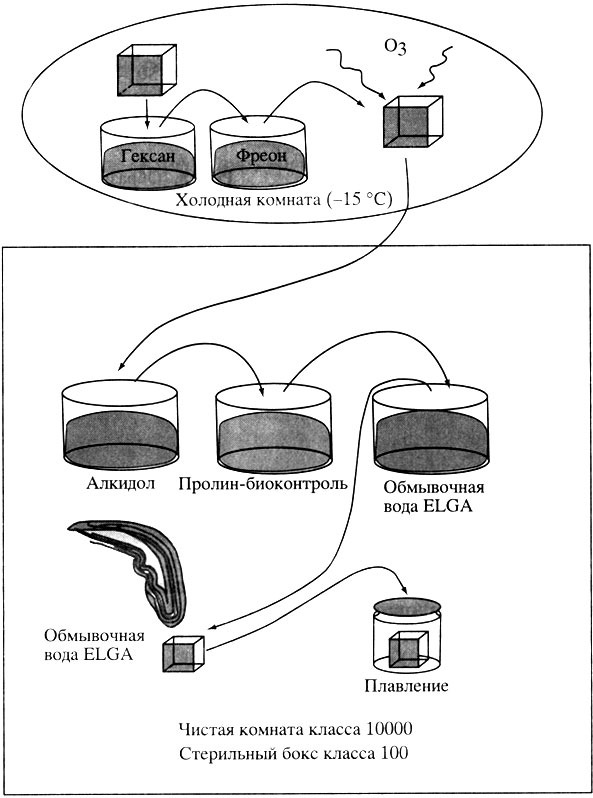
Рис. 3. Принципиальная схема деконтаминации и обработки образцов льда малого размера
Приемы контроля за загрязнением
В качестве основного приема контроля загрязнения обработанных кернов льда (воды) нами был выбран постбиологический контроль, основанный на использовании баз контаминантов при анализе обнаруженных микробов на предмет их отнесения к загрязнению или истинной биоте льда. Для этого создана (и постоянно пополняется) библиотека контаминантов, состоящая в настоящее время из пяти самостоятельных баз данных, основанных на анализе 156 последовательностей ДНК:
1) негативный контроль в ПЦР (ПЦР без ДНК);
2) буровая жидкость;
3) (неочищенная) поверхность керна льда;
4) вода для обмывки льда;
5) лабораторное окружение (пыль-воздух).
Кроме того, из опубликованных статей [Tanner et al., 1998] и мировых баз данных (GenBank) подобраны доступные данные по контаминантам в ПЦР, которые можно рассматривать в качестве 6-й базы данных.
На примере образца атмосферного льда с глубины 3001 м выполнен специальный эксперимент по идентификации бактерий, которые могут представлять поверхностное загрязнение керна (буровая жидкость, микрофлора человека и др.), с целью их последующего "вычитания" из наблюденной микрофлоры льда. Образец льда, предварительно обрезанный простерилизованной пилой со всех сторон (за исключением одной), был последовательно нарезан на слои (рис. 4). Внешний ("грязный") образец был обработан без использования какой-либо промывочной воды. Полученную сконцентрированную воду затем проанализировали методами молекулярной биологии, включая экстракцию ДНК, ее амлификацию в ПЦР и клонирование/секвенирование ПЦР продуктов.
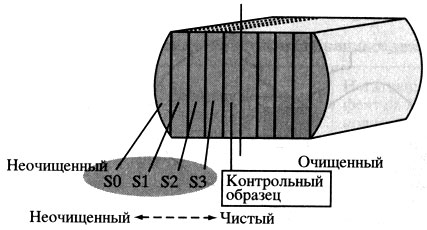
Рис. 4. Схема эксперимента по выявлению поверхностной микрофлоры кернов льда. Образец керна с глубины 3001 м, S0 - (неочищенная) поверхность керна льда; S3, Sk - внутренние ('чистые') слои керна
В результате эксперимента была создана база контаминантов неочищенной поверхности керна льда. В настоящее время она содержит самые различные бактерии, включая керосин-деградирующие бактерии (20-30%) типа Sphingomonas yanoikuyae, а также комменсалы и патогены человека (25%), например Acinetobacter lwoffii.
База "негативного контроля в ПЦР" (апмлификация без добавленной ДНК с последующим клонированием и секвенированием фрагментов - фактически контроль на реагенты для ПЦР, включая ПЦР-воду и ДНК-полимеразы) в настоящее время состоит из четырех основных видов, которые нужно учитывать при работе со льдом: Bradyrhizobium sp. (вносимый из почвы?) и Asticcacaulis sp., Caulobacter sp. и Sphingomonas koreensis (все вносимые с водой). Два из них - Asticcacaulis sp. (Afipia sp.) и Caulobacter sp. - уже были найдены в образцах льда керна со ст. Восток [Priscu et al., 1999; Abyzov et al., 2001; Christner et al., 2001].
Особый интерес представляет база контаминантов оригинальной (отобранной из скважины 5Г-1) буровой жидкости, на которой остановимся подробнее.
Сначала предполагалось десять образцов заливочной жидкости, отобранных из интервала глубин 110-3600 м, отфильтровать через фильтры 3000 дальтон, собрав тем самым все клетки и даже свободную ДНК. Однако эта схема эксперимента провалилась. Буровая жидкость, состоящая, как известно, из смеси керосина и фтордихлорэтана, содержит невидимую глазом фракцию, которая образовала "клейкую" пленку, полностью блокирующую поры использованных фильтров при фильтровании. Поэтому, нами была разработана новая методика извлечения из буровой жидкости присутствующих в ней клеток. Она заключается в экстракции клеток и ДНК из смеси "керосин-вода" в водную фракцию в ходе длительного перемешивания с последующим отделением и отбором этой воды на анализ. В результате из шести образцов, отобранных из всего диапазона глубин (110-3600 м), рис. 5, была успешно выделена ДНК и затем амплифицирована в ПЦР.

Рис. 5. Образцы буровой жидкости, отобранные с различных глубин из скважины 5Г-1
На основе анализа 33 клонов рибДНК, выделенных из четырех образцов буровой жидкости с глубин 110, 2750, 3400 и 3600 м, которые при идентификации дали 8 видов бактерий, можно заключить, что буровая жидкость с разных горизонтов содержит бактерии различного происхождения. Даже образцы из близких горизонтов (3400 и 3600 м) различаются по видовому составу. Поэтому для полного представления о микробном составе жидкости для бурения, особенно в наиболее глубоких горизонтах, важных с точки зрения возможного воздействия на экологию и биоту озера Восток, требуются дополнительные исследования.
В частности, на настоящий момент полученные данные свидетельствуют, что жидкость для бурения содержит четыре основных вида бактерий:
- в верхнем горизонте атмосферного льда (110 м) один вид дельта-протеобактерий - неизвестный (80-81% гомологии) представитель Desulfobacteraceae, способных окислять сульфаты и разлагать бензены, присутствующие, как известно, в нефти и продуктах ее переработки;
- в нижнем горизонте атмосферного льда (3400 м) один вид альфа-протеобактерий - Sphingomonas natatoria, который может деградировать керосин;
- в горизонте озерного льда (3600 м) два вида: один, представляющий близкородственные виды альфа-протеобактерий Sphingomonas из группы S. aurantiaca, которые могут деградировать керосин, а второй - близкородственный патогену человека Haloanella gallinarum из CFB группы бактерий.
Кроме того, в образцах были встречены еще четыре вида бактерий: единичные представители патогенов и сапрофитов человека (например, Staphylococcus cohnii из грам-позитивных бактерий и клон, родственный Haemophilus influenzae, из гамма-протеобактерий), а также почвенные бактерии (из ризосферы сельскохозяйственных бактерий и деструкторов древесины - 92-93% гомологии с миксобактериями Chondromyces apiculatus или С. robustus). Присутствие этих бактерий не имеет однозначного объяснения и рассматривается нами как случайное загрязнение самой жидкости для бурения при ее отборе или обработке в ходе экстракции ДНК.
Отметим также, что в образце жидкости с горизонта 2750 м достоверно не обнаружено ни одной бактерии.
В целом из четырех основных бактерий, обнаруженных в буровой жидкости, только три имеют прямое отношение к деградации керосина. Четвертый вид - патоген человека - следует рассматривать как результат загрязнения керосина человеком.
Интересно, что две из обнаруженных бактерий - Sphingomonas natatoria и Sph. sp. из группы S. aurantiaca - при анализе мировых баз данных оказались идентичны (или в пределах вида) бактериям, обнаруженным Б. Крист-нером в озерном льду со станции Восток (глубина 3593 м), а также в кернах ледникового льда из других районов Антарктиды [Cristner et al., 2001; Christner, 2002]. Это означает, что проанализированные им образцы льда содержали остатки буровой жидкости и, следовательно, контаминанты.
Таким образом, впервые проведенный анализ оригинальной буровой жидкости позволил уточнить истинное происхождение некоторых видов бактерий, найденных нами во льду, и даже показать, что находки, раннее сделанные другими исследователями, могут представлять загрязнение. Поэтому можно заключить, что удаление остатков буровой жидкости (и, следовательно, привносимых с нею микробов) с керна льда представляет достаточно сложную проблему [Vincent, 1999, 2000], которую мы планируем решить с помощью нового метода деконтаминации льда с использованием озона. Этот новый подход заключается не в удалении жидкости, загрязняющей поверхность керна, а в ее стерилизации.
Все выявленные нами контаминанты при работе с атмосферным и озерным льдом керна со станции Восток систематизированы в зависимости от источника загрязнения и оформлены в Библиотеку контаминантов. Ранее полученные последовательности ДНК заново проверены методом перекрестного выравнивания (alignment) и построения филогенетических деревьев с включением представителей баз контаминантов и микробов, обнаруженных в антарктических кернах и в других ледниках. Обнаруженные при этой процедуре случаи перекрытия отнесены также к контаминантам, что значительно пополнило Библиотеку контаминантов новыми видами и уточнило банк данных по истинному микробному разнообразию (рДНК) ледяного керна со станции Восток.
Следует также отметить, что в дополнение к разработанному нами постбиологическому контролю за загрязнением проб с использованием баз контаминантов непосредственно перед молекулярно-биологическим анализом обработанные нами образцы льда (воды) проверяются на содержание растворенного органического углерода (DOC), неорганических и органических кислот и солей, служащих индикаторами загрязнения.
В результате этих анализов было установлено, что керны атмосферного и озерного льда, обработанные нами, не различаются по DOC и химическим индикаторам загрязнения и содержат очень мало DOC (<20 ppb) и ничтожные количества (доли ppb) аммония и анионов неорганических (нитриты) и простых органических (формат и ацетат) кислот, что подтверждает эффективность используемого нами метода деконтаминации и обработки льда.
В ходе работ по выявлению микробного разнообразия в атмосферном и озерном льдах были разработаны и апробированы методы молекулярной биологии, в том числе осуществлен дизайн и синтез оригинальных, усовершенствованных праймеров на рибДНК для большинства порядков бактерий, цианобактерий, архебактерий, грибов, а также оптимизированы условия ПЦР - выбран метод полугнездовой ПЦР, позволяющий вскрывать 2-8 клеток в 1 мл талой воды. Отдельно для цианобактерий выполнен дизайн цианобактерио-специфичных праймеров.
Биологические находки в атмосферном льду
Проведенный молекулярно-биологический анализ образцов льда с глубин 2046 и 3483 м показал, что среди большого количества контаминантов пока только Psychrobacter glacincola и два клона Bacillus (царство Бактерии) можно более или менее однозначно "приписать" образцам глубинного атмосферного льда над оз. Восток [Alekhina et al., 2001]. То же можно сказать об образце льда с глубины 3001 м: из обнаруженных пяти бактерий лишь одна - неидентифицированный представитель отдела CFB (Cytophagales) - прошла все тесты (сравнение с базами контаминантов) и на сегодняшний день представляет единственную надежную находку на этом горизонте.
В отличие от бактерий, для которых проблема контаминации особенно остра, все три обнаруженных вида грибов (царство Грибы) в образцах льда с глубин 2046 и 3483 м однозначно происходили из льда [Alekhina et al., 2001]. Из них, используя мировые базы данных, удалось идентифицировать только Penicillium chrysogenum, тогда как два других вида остались не определены. Один из них, по-видимому, представляет неизвестный науке зигомицет. Попытки оживить грибы, проведенные во Всероссийской коллекции микроорганизмов (Москва), не дали результатов. Это может свидетельствовать о том, что пропагулы данных грибов крайне малочислены и/или не культивируются вообще (известно, что более 90% грибов не культивируются [Hawksworth, 1997]), либо разрушены при длительном нахождении в глубинных слоях ледника.
Выполнен молекулярно-биологический анализ микрофлоры поверхностного снега со станции Восток с возрастом 15-20 лет, в частности, на присутствие пыльцы высших растений и цианобактерий. В результате показано, что поверхностный снег содержит пыльцу нескольких видов высших растений, включая Nothofagus. Сделана попытка идентифицировать (по ДНК выявленной пыльцы) виды Nothofagus с целью реконструкции воздушных потоков в районе ст. Восток 15-20 лет назад, ибо известно, что пыльца разных видов Nothofagus (южноамериканских или австралийских) может служить в качестве маркера источников атмосферной пыли и путей их поступления на ледяной континент [Manos, 1997]. В контрольную выборку были включены 11 видов Nothofagus - представителей флоры Южной Америки и Австралии-Тасмании, Новой Зеландии и Океании (коллекция П. Маноса, США). Однако по выбранному участку ДНК (пластидная 16S рибосомная ДНК) в связи с его эволюционной консервативностью (и соответственно с низкой информативностью) оказалось невозможно отличить южноамериканские виды Nothofagus от видов из Новой Зеландии и Австралии. В дальнейшем планируется проверить другие, более вариабельные участки рибДНК.
В тех же образцах поверхностного снега с использованием разных схем ПЦР для цианобактерий удалось идентифицировать только неизвестные цианобактерии из группы некультивируемых пикоцианобактерий, ранее обнаруженных в пресноводных озерах. Таким образом, в поверхностном снегу в районе станции Восток с возрастом 15-20 лет практически нет известных цианобактерий.
Биологические находки во льду озера Восток
Молекулярно-биологический анализ образцов озерного льда I типа (горизонты 3546, 3571 и 3604 м) показал отсутствие в них известных (по мировым базам данных) представителей цианобактерий (древнейшие из царства Бактерии), архебактерий (царство Архея) и грибов. Однако в специальных ("неспецифичных") условиях ПЦР с "архейными" и "грибными" праймерами в этих образцах была обнаружена ДНК неизвестного происхождения. Один образец такой ДНК (3571 м) показал отдаленное родство с известными сульфитредук-тазами бактериального происхождения, тогда как остальные ДНК-клоны (3604 м) до настоящего времени идентифицировать не удалось.
В целом полученные данные по цианобактериям, архебактериям и грибам свидетельствуют: если в неглубоком заливе, где, как полагают, происходит образование озерного льда I типа, и живут организмы данных групп, то по крайней мере не в таких видовых формах, которые известны в настоящее время [Jouzel et al., 1999; Bell et al., 2002].
Отметим, что проанализированный на грибы один образец озерного льда II типа (3619 м) также показал их отсутствие. Таким образом, и озерный лед II типа, по-видимому, не содержит грибов или их ДНК, пригодной для ПЦР.
Был проведен молекулярно-биологический анализ образцов озерного льда I типа, содержащего минеральные включения (два образца с глубины 3607 м и один образец с глубины 3551 м) на присутствие бактерий (подавляющее число отделов царства Бактерии). Для сравнения использовали атмосферный лед с горизонта 3001 м. В общей сложности из трех образцов озерного льда секвенировали 84 клона, их анализ привел к различению 13 бактерий. Все бактерии были тщательно проанализированы на предмет их возможной принадлежности к контаминантам (156 клонов), и 9 из них были признаны контаминантами. Одному таксону, родственному некультивируемой альфа-протеобактерии AJ459874 и найденному как в озерном, так и в атмосферном льду, но отсутствовавшему в базах контаминантов, был присвоен ярлык "временный чужеземец", означающий, что данный микроорганизм проник в озеро из атмосферного льда и был вновь вморожен в озерный лед [Siegert et al., 2002]. Только три бактерии (несколько клонов для каждой) прошли строгий тест на контаминацию и тем самым были признаны истинными находками в озерном льду керна со станции Восток.
| Образец, м | Гомология, % | Ближайший родственник в базах данных | Возможное происхождение |
|---|---|---|---|
| 3607* | 81-82 | ОР11 Uncultured bacterium. Штаммы из седиментов гидротермального бассейна Гайама (Мексика); анаэробно окисляет метан и/или восстанавливает сульфаты | Седименты озера? |
| 3607 | 99-100 | α-Proteobacteria. Hydrogenophilus thermoluteolus из горячих источников п-ова Изу (Япония) и Йеллостоуна (США); окисляет водород | Седименты озера? |
| - | 96 | β-Proteobacteria. Штамм из гидротермальных источников в районе Галапагосских о-ов; окисляет тиосульфат | Седименты озера? |
(*Содержит минеральное включение)
Эти бактерии (три разных вида) оказались хемолитоавтотрофными ме-зотермофилами, родственники которых развиваются в гидротермальных источниках активных областей океанов и континентов при температурах 40-60 °С (табл. 2) [Bulat et al., 2002]. Первый вид (Hydrogenophilus thermoluteolus) (рис. 6) представлен микроорганизмами, обнаруженными в горячих источниках (США, Япония) и в глубоких шахтах (Япония) и способными окислять водород в присутствии углекислого газа как источника углерода [Hayashi et al., 1999; Stohr et al., 2001]. Второй вид, родственный штаммам группы Roseobacter, выделенным из гидротермальных вентов в районе Галапагосских островов, принадлежит к тионовым бактериям, в частности, окисляет тиосульфаты [Teske et al., 2000]. Третий вид оказался родственным штаммам некультивируемых бактерий отдела ОР11, выделенным из осадков глубоководного (2 км) гидротермального бассейна Гайама (Калифорнийский залив, Мексика) [Teske et al., 2002] и глубоководной (4 км) впадины Изу-Бонин (Японские острова) [Li et al., 1999] и обитающим анаэробно в органически богатой среде, содержащей сульфиды-сульфаты и метан [Teske et al., 2002].
![Рис. 6. Микрофотография (сканирующий электронный микроскоп) бактерии Hydrogenophilus thermoluteolus, выделенной из горячих источников в Японии [Hayashi et al., 1999]. Точно такая же бактерия обнаружена нами в ледяном керне с глубины 3607 м](pic/000048.jpg)
Рис. 6. Микрофотография (сканирующий электронный микроскоп) бактерии Hydrogenophilus thermoluteolus, выделенной из горячих источников в Японии [Hayashi et al., 1999]. Точно такая же бактерия обнаружена нами в ледяном керне с глубины 3607 м
Таким образом, впервые удалось идентифицировать бактерии, с большой вероятностью представляющие истинную микробиоту оз. Восток, и тем самым положить начало созданию банка данных по микробному разнообразию (16S рДНК) керна озерного льда. Предположительно эти бактерии жили 15-20 тыс. лет назад на дне озера (в неглубоком заливе), в осадках около глубоких разломов или в них самих [Масолов и др., 2001], где вода может быть горячей. Периодические поступления этой воды в озеро возможны благодаря эпизодическим тектоническим подвижкам [Leitchenkov et al., 1998; Studinger et al., 2002]. Для своей жизнедеятельности (энергетики) бактерии могли использовать редуцированные элементы и неорганические соединения (например, водород, сероводород, сульфиды, тиосульфаты и, возможно, метан), образующиеся в избытке в результате взаимодействия горных пород и горячей воды, находящейся под давлением, а также окисленные соединения из озерной воды (углекислый газ, кислород, сульфаты) и выполнять целый спектр окислительно-восстановительных реакций, в том числе продуцировать и окислять метан, по-видимому, присутствующий в воде озера.
В заключение отметим еще раз, что только единичные находки из озерного льда и пока только в одном образце (3607 м) выдержали "тест на контаминацию", что свидетельствует, с одной стороны, о сложности чистой работы со льдом керна со станции Восток, а с другой - о чрезвычайно низком титре (содержании) живых (с ДНК, пригодной для ПЦР) микробов в озерном льду и, следовательно, в воде озера. Если вышеприведенный сценарий низкотемпературного биотектонического сообщества верен, то больше находок и большее их разнообразие следует ожидать в осадках озера.
Заключение
При работе с атмосферным льдом, несмотря на предпринятые меры, полностью предотвратить контаминацию не удалось. В результате было вскрыто много контаминантов различной природы. Однако использование созданных баз контаминантов позволило отделить истинные редкие (единичные) находки от загрязнения.
По нашим представлениям, атмосферный лед керна со станции Восток - очень чистый [Булат и др., 2002] и практически не содержит клеток/ДНК, пригодных для ПЦР, что может объясняться плохой сохранностью ДНК (тем более клеток) в глубоких горизонтах льда. Вероятно, это происходит из-за высокого содержания в нем воды в жидкой фазе и растворенного кислорода [Lipenkov et al., 2002], так как известно, что оба эти фактора губительны для сохранности ДНК [Lindahl, 1993]. В связи с этим идея использовать ледник как хранилище геномов и морф с целью изучения биоразнообразия и эволюции микроорганизмов во времени (на протяжении 1-2 млн лет) [Abyzov et al., 1993] представляется трудно реализуемой.
При работе с озерным (как и с атмосферным) льдом, несмотря на предпринятые меры, полностью предотвратить контаминацию не удалось. Также было вскрыто много контаминантов различной природы, и лишь использование созданных баз контаминантов позволило отделить истинные редкие (единичные) находки от загрязнения. В результате пока лишь три бактерии - все мезотермофильные хемолитоавтотрофы - можно рассматривать в качестве представителей микробиоты озера, которая, по-видимому, сконцентрирована в его осадках в районе глубоких разломов коры, где вода может прогреваться геотермально и эпизодически высвобождаться в результате слабых по мощности, но постоянных (в геологическом масштабе времени) тектонических событий.
По нашим представлениям, озерный лед керна со станции Восток в целом (I и II типов), как и атмосферный лед, практически не содержит клеток/ДНК, пригодных для ПЦР. Это может объясняться как плохой сохранностью ДНК (а тем более клеток), которая церед заморозкой могла "сгореть" в холодном кислородном реакторе, который представляет собой вода озера из-за избытка растворенного в ней кислорода [Lipenkov et al., 2002], так и чрезвычайно малым содержанием биологического материала во льду, которое оценивается нами в несколько бактериальных клеток и менее одной грибной клетки на 1 мл воды. Вместе с тем озерный лед I типа содержит больше клеток или неповрежденной ДНК, чем атмосферный лед, что, по-видимому, обусловлено присутствием в нем минеральных включений.
В плане сравнительного анализа микробного разнообразия в образцах атмосферного и озерного льда керна со станции Восток полученные по настоящее время данные свидетельствуют об отсутствии перекрытия, за исключением, возможно, лишь одной проверяемой в настоящее время находки - неидентифицированной бактерии, отдаленно родственной одному из видов Caulobacter.
В целом отметим, что лишь методы молекулярной биологии в сочетании с практикой судебной медицины, под которой мы понимаем работу в суперчистых условиях на уровне единичных клеток или молекул, позволили выявить, как мы считаем, истинных обитателей озера Восток, что уже привело к пересмотру современных представлений о его геологии, гидротермальном режиме, газовом составе и микробиоте [Petit et al., 2002; Bulat et al., 2003, in press].
Литература
Булат С. Л., Алехина И. А., Крыленков В. А., Лукин В. В. Молекулярно-биологические исследования микробиоты подледникового озера Восток, Антарктика//Успехи соврем, биологии. 2002. Т. 122. С. 211-221.
Масолов В. Н., Лукин В. В., Шереметьев А. Н., Попов СВ. Геофизические исследования подледникового озера Восток в Восточной Антарктиде//Докл. РАН. 2001. Т. 379, № 5. С. 680-685.
Abyzov S. S. Microorganisms in the Antarctic ice//Antarctic microbiology. N.Y.: Wiley-Liss, 1993. p. 265-295.
Abyzov S. S. et al. Microflora in the basal strata at Antarctic ice core above the Vostok lake//Adv. Space Res. 2001. Vol. 28. P. 701-706.
Alekhina I., Bulat S., Barkov N. Studying temporal microbial diversity: The case of glacial deep ice cores, above the Lake Vostok, Antarctica//Antarctic biology in a global context: Abstract of VIII SCAR Intern, biology symp., 27 Aug.-l Sept. 2001. Amsterdam: Vrije Univ., 2001. Abstr. S3P01.
Bell R. E. et al. Origin and fate of Lake Vostok water frozen to the base of the East Antarctic ice sheet//Nature. 2002. Vol. 416. P. 307-310.
Bulat S. A., Alekhina I. A., Blot M. et al. Thermophiles microbe signature in Lake Vostok, Antarctica//Eos. Trans. AGU. 2002. Vol. 83, N 19: Spring Meet. Suppl. Abstr. B21A-09.
Bulat S., Alekhina I., Blot M. et al. Hydrothermal-related bacteria in the accretion ice of Lake Vostok, Antarctica//Science, (in press).
Carr M. H. et al. Evidence for a subsurface ocean on Europa//Nature. 1998. Vol. 391. P. 363-365.
Christner B. C. Recovery of bacteria from glacial and subglacial environments: Ph.D. Thesis, Ohio State Univ. Columbus (OH), 2002.
Christner В., Mosley-Thompson E., Thompson L., Reeve J. Isolation of bacteria and 16S rDNAs from Lake Vostok accretion ice//Environ. Microbiol. 2001. Vol. 3. P. 570-577.
Hawksworth D. L. The fascination of fungi: Exploring fungal diversity//Mycologist. 1997. Vol. 11. P. 18-22.
Hayashi et al. Hydrogenophilus thermoluteolus gen. nov., sp. nov., a thermophilic, facultatively chemolithoautotrophic, hydrogen-oxidizing bacterium//Intern. J. Syst. Bacteriol. 1999. Vol. 49. P. 783-786.
Jouzel J. et al. More than 200 meters of lake ice above subglacial Lake Vostok, Antarctica//Science. 1999. Vol. 286. P. 2138-2141.
Karl DM. et al. Microorganisms in the accreted ice of Lake Vostok, Antarctica//Science. 1999. Vol. 286. P. 2144-2147.
Leitchenkov G. L., Verkulich S. R., Masolov V. N. Tectonic setting of Lake Vostok and possible information contained in its bottom sediments//Abstr. of Intern, workshop "Lake Vostok study: Scientific objectives and technological requirements", Mar. 24-26, 1998. St. Petersburg, 1998. P. 62-65.
Li L., Kato C., Horikoshi K. Bacterial diversity in deep-sea sediments from different depths//Biodiversity and Conservation. 1999. Vol. 8. P. 659-677.
Lindahl T. Instability and decay of the primary structure of DNA//Nature. 1993. Vol. 362. P. 709-715.
Lipenkov V. Ya., Istomin V. A., Bulat S. A. et al. An estimate of the dissolved oxygen concentration in subglacial Lake Vostok//Eos. Trans. AGU. 2002. Vol. 83, N 19: Spring Meet. Suppl. Abstr. B21A-06.
Manos P. S. Systematics of Nothofagus (Nothofagaceae) based on rDNA spacer sequences (ITS): Taxonomic congruence with morphology and plastid sequences//Amer. J. Bot. 1997. Vol. 84. P. 1137-55.
Pappalardo R. T. et al. Geological evidence for solid-state convection in Europa's ice shell//Nature. 1998. Vol. 391. P. 365-368.
Petit J. R. et al. Climate and atmospheric history of the past 420,000 years from the Vostok ice core, Antarctica//Nature. 1999. Vol. 339. P. 429-436.
Petit J. R., Ritz C., Baptiste P. J. et al. Hot spots in Lake Vostok?//Eos. Trans. AGU. 2002. Vol. 83, N 19: Spring Meet. Suppl. Abstr. B21A-05.
Priscu J. et al. Geomicrobiology of subglacial ice above Lake Vostok, Antarctica//Science. 1999. Vol. 286. P. 2141-2143.
Siegert M. et al. Physical, chemical and biological processes in Lake Vostok and other Antarctic subglacial lakes//Nature. 2002. Vol. 414. P. 603-609.
Stohr R. et al. Hydrogenophilus hirschii sp. nov., a novel thermophilic hydrogen-oxidizing beta-proteobacterium isolated from Yellowstone National Park//Intern. J. Syst. Evol. Microbiol. 2001. Vol. 51. P. 48L488.
Studinger M. et al. Lake, from continental margin to a subglacial lake//Eos. Trans. AGU. 2002. Vol. 83, N 19: Spring Meet. Suppl. Abstr. B21A-03.
Tanner M. A., Goebel B. M., Dojka M. A., Pace N.R. Specific ribosomal DNA sequences from diverse environmental settings correlate with experimental contaminants//Appl. Environ. Microbiol. 1998. Vol. 64. P. 3110-3113.
Teske A. et al. Diversity of thiosulfate-oxidizing bacteria from marine sediments and hydrothermal vents//Ibid. 2000. Vol. 66. P. 3125-3133.
Teske A. et al. Microbial diversity of hydrothermal sediments in the Guaymas Basin: evidence for anaerobic methanotrophic communities//Ibid. 2002. Vol. 68. P. 1994-2007.
Vincent W. F. Icy life on a Hidden Lake//Science. 1999. Vol. 286. P. 2094-2095.
Vincent W. F. Evolutionary origins of Antarctic microbiota: invasion, selection and endemism//Antarctic Science. 2000. Vol. 12. P. 374-85.
|
ПОИСК:
|
© ANTARCTIC.SU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://antarctic.su/ 'Арктика и Антарктика'
При использовании материалов сайта активная ссылка обязательна:
http://antarctic.su/ 'Арктика и Антарктика'